mercoledì 30 dicembre 2015
pronto soccorso: steri strip
categoria: pronto soccorso
Uso degli steri-strip
I cerotti conosciuti con il termine "steri strip" permettono di risolvere piccole emergenze sanitarie senza doversi rivolgere ad un pronto soccorso per l'applicazione di punti tradizionali.
trattamento di piccole ferite (immagini da remotemedicine.blogspot.it)
Una piccola lesione della pelle, superficiale, viene pulita dai corpi estranei e disinfettata. I margini cutanei della ferita vengono riavvicinati usando gli "steri strip" e coperti poi da una medicazione sterile.
Il video della 3M sull'uso degli steri strip
domenica 20 dicembre 2015
machete in dotazione ai piloti russi
categoria: sopravvivenza
machete in dotazione ai piloti russi
Armed to the teeth: Russian air force gives its pilots pistols and Kalashnikovs in case any more are shot down by Turks amid rising tensions.
I piloti russi hanno ricevuto pistole e kalashnikov per difesa, in caso di abbattimento in Siria.
Il video del Daily Mail mostra la pistola data in dotazione ai piloti russi per autodifesa in caso di abbattimento e il kit di sopravvivenza. Il giornalista estrae e mostra alle telecamere il machete
giovedì 17 dicembre 2015
pronto soccorso, vecchie riviste: Suturare una ferita
categoria: pronto soccorso, vecchie riviste
Suturare una ferita
Leggendo un vecchio numero di "American Survival Guide" ho trovato questo interessante articolo.
martedì 15 dicembre 2015
lunedì 14 dicembre 2015
vecchie riviste: dinamo a manovella
categoria: vecchie riviste
Energia elettrica con sistema a manovella
il prodotto deriva dai modelli militari in uso ancora durante la seconda guerra mondiale, ma resta un sistema valido anche ora se il sole manca o il serbatoio del generatore a gasolio è a secco.
Girando su internet questo modello è ancora disponibile e a prezzi interessanti.
mercoledì 9 dicembre 2015
categoria: vecchie riviste I coltelli Kershaw. American survival guide 1984
categoria: vecchie riviste
I coltelli Kershaw. American survival guide 1984
Dal catalogo 2015 (kershawknife.com):
giovedì 26 novembre 2015
Le emorragie e l'uso dell'acido tranexamico (studio CRASH-2; MATTERs study)
categoria: pronto soccorso
Le emorragie e l'uso dell'acido tranexamico
I traumi rappresentano una delle principali cause di morte al mondo. Circa un terzo delle morti per trauma che avvengono in ospedale sono riconducibili ad una emorragia. I lacci emostatici e gli agenti emostatici (Combat Gauze) sono inutili nelle emorragie interne, mentre l’acido tranexamico (TXA) aiuta a fermare l'emorragia.
Il meccanismo dell’emostasi
L’emostasi è il processo
fisiologico mediante il quale si arresta il sanguinamento da un vaso sanguigno
leso. L’emostasi richiede l’attività combinata di fattori vascolari,
piastrinici e plasmatici; parallelamente si attivano i meccanismi che limitano l’accumulo
di piastrine e di fibrina all’area danneggiata.
L’attività fibrinolitica, basata
sulla conversione del plasminogeno in plasmina, degrada per via enzimatica la
fibrina riuscendo a dissolvere i coaguli di sangue. In caso di intervento
chirurgico maggiore o trauma, il danno ai tessuti fa prevalere il processo
della fibrinolisi; gli agenti antifibrinolitici si usano in chirurgia per
ridurre la perdita ematica nei pazienti con fibrinolisi normale o accentuata e diminuire
la necessità di trasfusioni, apparentemente senza aumento del rischio di
complicanze postoperatorie, legati alla formazione di microcoaguli all’interno
delle arterie e delle vene.
L’acido tranexamico (TXA)̀, un derivato sintetico dell’aminoacido lisina, si lega
competitivamente ai siti di legame della lisina sulla molecola del
plasminogeno, bloccando la trasformazione l’attivazione in plasmina.
Il farmaco è impiegato
prevalentemente per trattare la menorragia e a scopo preventivo negli emofilici
che devono sottoporsi ad estrazioni dentarie. Alcuni odontoiatri lo usano per
via topica nelle sedi cavitarie che sanguinano abbondantemente.
L’analogia delle risposte
emostatiche in caso di intervento chirurgico e di trauma ha portato alla
realizzazione di uno studio su una casistica molto ampia, che ha coinvolto 274
ospedali in 40 paesi e 20.000 pazienti.
Lo studio, denominato CRASH-2 (Clinical Randomisation of an
Antifibrinolytic in Significant Haemorrhage), pubblicato su The Lancet, ha
analizzato gli effetti della somministrazione precoce di acido tranexamico, il
rischio di eventi occlusivi vascolari e la necessità di trasfusioni in pazienti
traumatizzati con emorragia grave in atto o attesa.
I pazienti hanno ricevuto una
infusione endovenosa di 1 g di acido tranexamico in 10 minuti con 100 cc di
soluzione fisiologica o Ringer lattato, seguita da una infusione di 1 g in 8
ore. I casi di controllo sono stati trattati con soluzione salina allo 0,9%. L’acido
tranexamico è somministrato mediante infusione lenta, per ridurre il rischio di
ipotensione.
Il principale criterio di
valutazione di efficacia era rappresentato dalla percentuale dei decessi per
qualsiasi causa avvenuti in ospedale nelle 4 settimane successive al ricovero.
La mortalità totale è stata del 16% nei pazienti trattati con placebo e del
14,5% in quelli trattati con acido tranexamico. La differenza a favore
dell’acido tranexamico, corrispondente ad una riduzione del rischio assoluto
dell’1,5%, significativa sotto il profilo statistico (una vita salvata ogni 66
pazienti trattati).
L’incidenza di eventi occlusi
vascolari fatali e non fatali (ictus, infarto miocardico, embolia polmonare) è risultata 0,3% e
1,4% nel gruppo placebo contro 0,5% e 1,5% nel gruppo acido tranexamico.
Adottando come criterio di
valutazione solo la mortalità specifica per emorragia e analizzando la
tempistica del trattamento con gli esiti clinici, lo studio ha dimostrato che
tanto più precocemente l’acido tranexamico è somministrato tanto maggiore è
il beneficio. Il trattamento effettuato entro un’ora dal trauma ha diminuito il
rischio di morte per emorragia dal 7,7% al 5,3%, pari ad una riduzione del
rischio assoluto del 2,4% (una vita ogni 42 traumatizzati gravi); la
somministrazione è ancora utile quando fatta entro tre ore dal ferimento. La
somministrazione oltre tre ore dal trauma ha aumentato il rischio di morte per
emorragia: i decessi sono infatti risultati 144 (su 3.272 pazienti) contro 103
(su 3.362 pazienti) trattati con placebo, pari al 4,4% contro 3,1%.
Possibili effetti indesiderati
nausea, vomito, diarrea
disturbi visivi
possibile aumento del rischio di
coaguli post-infortunio
ipotensione, se somministrato come
bolo endovenoso
Conservazione e trattamento
Intervallo di temperatura
consigliato per la conservazione: 15 – 30°C. Proteggere questo farmaco da
condizioni ambientali estreme (conservare e trasportare in strutture con aria
condizionata; in missione i militari portano il farmaco in un piccolo
contenitore coibentato nello zaino di pronto soccorso e, in caso di temperature
molto rigide, portano il TXA accanto al corpo).
Un recente editoriale pubblicato
su “The Medical Journal of Australia” dal
titolo “Trauma and
tranexamic acid” a firma di Russell L Gruen, Ian G Jacobs e Michael
C Reade pone alcuni dubbi sia sul metodo che sul merito dello studio CRASH-2.
In particolare lo stato ipercoagulativo indotto dall’Acido Tranexamico potrebbe
(teoricamente) favorire l’insorgenza di complicanze spesso fatali, come
l’embolia polmonare e la trombosi venosa profonda, tipiche del paziente
politraumatizzato. Complicanze risultate molto rare nel CRASH-2, ma più
numerose nello studio parallelo condotto in ambito militare (Military
Application of Tranexamic Acid in Trauma Emergency Resuscitation; MATTERs study):
rispettivamente 9 e 12 volte maggiori nella popolazione trattata con Acido
Tranexamico rispetto a quella di controllo. (www.ncbi.nlm.nih.gov)
La riduzione dell’azione
fibrinolitica della plasmina tende ad indurre una coagulopatia acuta post-traumatica
(ATC), soprattutto nei pazienti politraumatizzati massivamente trasfusi. Poiché
l’acido Tranexamico fa parte dei protocolli in cui sono previsti alte dosi di
emazie concentrate o di altri fattori ematici, il dubbio sorge spontaneo, ma lo
studio CRASH-2 non indaga in maniera soddisfacente su questo punto.
A tal proposito sono già in programma (negli USA ed in
Australia) altri trial che prenderanno in considerazione i dubbi lasciati
irrisolti da CRASH-2.
lunedì 23 novembre 2015
emostasi 3
categoria: pronto soccorso, farmacologia
Trombo, embolo
Il trombo è una massa semisolida,
costituita da cellule ematiche e fibrina, che si origina da un'inopportuna
attivazione dell'emostasi. Presenta forme e dimensioni variabili: da piccole
masse vagamente sferiche a strutture allungate in cui si possono distinguere
una "testa", nel punto di origine del trombo, ben adesa alla parete,
un "corpo" ed una "coda" libera nel lume del vaso. I trombi
si possono sviluppare in qualsiasi punto del sistema cardiovascolare:
all'interno delle cavità cardiache, sulle cuspidi valvolari, nelle arterie,
nelle vene e nei vasi del microcircolo.
L'embolo è un frammento di un
trombo (ma potrebbe anche essere di altra natura es.lipidica, gassosa,
neoplastica) che viene trasportato in una sede lontana dall'origine, in
qualunque punto dell'albero vascolare, andando a bloccare i vasi di calibro
troppo piccolo per permetterne il passaggio e determinando quindi un'occlusione
parziale o totale del vaso stesso. La conseguenza più seria di un episodio
tromboembolico è la necrosi ischemica del tessuto irrorato dal vaso occluso
emostasi 2
categoria: pronto soccorso, farmacologia
Il meccanismo di coagulazione a cascata. I fattori di coagulazione
Durante il meccanismo di coagulazione
a cascata, una serie di fattori plasmatici, inattivi, si attiva in sequenza:
una determinata proteina attivata porta a trasformare la forma inattiva di una
seconda proteina in forma attiva; la seconda proteina attivata porta
all'attivazione di una terza proteina e così via. La successione di questa
cascata di eventi è strettamente specifica: la prima proteina attiva solo la
seconda, ma non può attivare la terza; tutto avviene quindi secondo uno schema
ben determinato. L'attivazione avviene alla presenza di particolari molecole
dette cofattori.
I fattori della coagulazione
I fattori della coagulazione sono di
varia natura. Per la maggioranza sono proenzimi (zimogeni) che, quando sono
attivati, svolgono una attività proteasica. Altri fattori, come l'VIII ed il V,
sono cofattori di natura non enzimatica, che servono a mantenere in adeguato
contatto un enzima con il substrato.
Altri componenti fondamentali nella
coagulazione sono:
-
i fosfolipidi, che costituiscono una
adatta superficie di reazione
-
gli ioni calcio, che favoriscono le
interazioni fra enzimi, cofattori e fosfolipidi.
Fattori Vitamina K-Dipendenti
I fattori emocaoagulativi sono
sintetizzati per lo più a livello epatico. Alcuni hanno necessità
dell'intervento della Vitamina K per essere sintetizzati: II, VII, IX e X.
Zimogeno: precursore inattivo di enzimi
proteolitici. Gli zimogeni , rispetto alla sequenza amminoacidica della
proteina matura, possiedono un frammento peptidico in più, che ne modifica la
struttura del sito catalitico così da renderlo non accessibile al substrato,
quindi inattivo. Questo frammento viene rimosso proteoliticamente o per
autocatalisi perdare la forma attiva.
Vitamina K : il nome deriva
dal termine Koagulation vitamin
Comunemente si distinguono due vie
principali che attivano il processo di coagulazione, la via estrinseca e
la via intrinseca, che convergono nella cosiddetta via comune.
La via estrinseca è la via più rapida che porta alla formazione di un coagulo in
un tempo molto breve, quantificabile in pochi secondi. Essa è attivata nel
momento in cui una lesione vasale produce la liberazione di fosfolipidi e di un
complesso di tipo proteico noto come fattore tissutale (anche tromboplastina
tissutale); gli altri fattori attivati sono i fattori plasmatici VII, X e V.
La via intrinseca della coagulazione è così denominata perché i suoi componenti
sono tutti presenti nel sangue. Questa via inizia quando il sangue viene a
contatto con superfici cariche negativamente, come quelle delle cellule
endoteliali danneggiate. La formazione di un coagulo, che richiede un periodo
di tempo di alcuni minuti, inizia con l'attivazione del fattore XII (fattore di
Hageman), i fattori XI, IX e VIII e i fattori che prendono parte alla via
estrinseca.
Dopo l'attivazione del fattore X (di
Stuart), le vie intrinseca ed estrinseca convergono in una via comune che porta alla formazione
della trombina, l'ultimo enzima della cascata che agisce sul fibrinogeno per
produrre fibrina.
Avvenuta la riparazione del vaso, il
coagulo deve essere dissolto al fine di evitare ostacoli alla circolazione del
sangue. Di questa dissoluzione si incarica la fibrinolisi, che converte, rappresenta il meccanismo fondamentale
attraverso il quale si dissolve il coagulo di fibrina, dopo che ha svolto la
sua funzione. La principale reazione della fibrinolisi è rappresentata dalla
conversione, per opera di attivatori enzimatici, del plasminogeno (proenzima
plasmatico, inattivo) nell'enzima proteolitico attivo plasmina, in grado di
degradare la fibrina in frammenti solubili.
emostasi 1
categoria: pronto soccorso, farmacologia
I meccanismi alla base del processo di Emostasi. Patologie collegate alla sua alterazione: manifestazioni trombotiche ed emorragiche.
L'emostasi è il processo che blocca
lo stravaso di sangue a seguito di un danno vascolare.
Una emostasi fisiologica, è il
risultato di un equilibrio fra i meccanismi che favoriscono il processo
emostatico e quelli antagonisti ad esso.
Lo spostamento dell'equilibrio nel
senso di un aumento o di una diminuzione dell'attività emostatica ha importanti
conseguenze patologiche:
•
una incontrollata attivazione
intravasale dell'emostasi, che dà luogo a manifestazioni trombotiche
•
un deficit del sistema emostatico,
che dà luogo a manifestazioni emorragiche
L'emostasi svolge quindi tre
funzioni:
- mantiene il sangue in uno stato
fluido senza coaguli nei vasi normali;
- ripara le continue microlesioni che
avvengono fisiologicamente alla parete endoteliale dei vasi dovute allo
scorrimento stesso del sangue senza provocare una coagulazione eccessiva che
porterebbe al blocco della circolazione;
- induce la rapida formazione di un
tappo emostatico (coagulazione) localizzato nel sito di una rottura del vaso,
bloccando la fuoriuscita del sangue (emorragia).
All'interno dei vasi si possono individuare quattro fasi :
•
riduzione del lume vasale (fase
vascolare)
•
formazione del tappo piastrinico
(fase piastrinica; emostasi primaria)
•
formazione del coagulo di fibrina (fase
coagulativa; emostasi secondaria)
•
dissoluzione del coagulo (fase
fibrinolitica)
Fase vascolare
La vasocostrizione o spasmo vascolare
è la prima risposta dell’organismo in risposta ad una lesione del vaso, tramite
un segnale nervoso che causa una contrazione della muscolatura liscia presente
nella pareti del vaso offeso e di quelli contigui alla lesione; la riduzione
del lume vasale porta ad un rallentamento della fuoriuscita di sangue una
riduzione del flusso sanguigno nell'area circostante. Se la lesione interessa
un capillare, lo spasmo vascolare è in genere sufficiente a bloccare
l'emorragia.
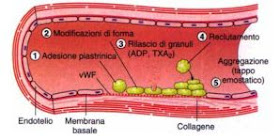
Emostasi primaria
La vasocostrizione è sostenuta e
prolungata dalle sostanze rilasciate dalle piastrine richiamate e accumulate
nel vaso danneggiato.
Giunte a livello della lesione le
piastrine aderiscono al collagene del vaso danneggiato, subiscono modificazioni
morfologiche con passaggio da una forma discoidale (discociti) ad una forma
sferica (sferociti), ed emissione di pseudopodi, dapprima corti, poi sempre
più lunghi, fino a rendere possibile il contatto tra piastrine vicine. Si
liberano quindi dei fosfolipidi e dei fattori piastrinici (sostanze con
attività vasocostrittrice e proaggregante, fattori della coagulazione e
inibitori della fibrinolisi) che aumentano la loro adesività favorendone
l'aggregazione (il trombossano è il più potente agonista della aggregazione
piastrinica).
Il richiamo in massa di altre
piastrine permette la formazione di un primo tappo emostatico instabile, detto
"trombo bianco", stabilizzato in seguito con la deposizione di
fibrina.
Emostasi secondaria
La fase coagulativa consolida il
tappo piastrinico tramite la deposizione di fibrina.
La fibrina è una proteina insolubile
che deriva dal fibrinogeno (la forma solubile nel plasma); i suoi filamenti
costituiscono una sorta di rete che intrappola le cellule del sangue, generando
il "trombo rosso" che chiude il vaso lesionato. In seguito alla
lesione del vaso sanguigno i fattori della coagulazione (numerati
progressivamente da 1 a 13 con numeri romani), normalmente presenti nel plasma nella
forma inattiva, sono attivati a cascata fino a determinare la trasformazione
del fibrinogeno plasmatico solubile nel polimero insolubile, la fibrina.
Formazione del trombo ed eventi
antitrombotici
Il trombo previene ulteriori emorragie. Contemporaneamente alla sua
costituzione, si attivano meccanismi di contro-regolazione (come il t-PA =
attivatore tissutale del plasminogeno che promuove la fibrinolisi) che limitano
il coagulo emostatico alla sede della lesione.
domenica 15 novembre 2015
Pilota sopravvive 31 giorni prima di essere ritrovato in Canada
Categoria: episodi di sopravvivenza, disastro aereo
Pilota sopravvive 31 giorni prima di essere ritrovato in Canada
Il Chicago Tribune, nel Dicembre 1972, pubblica la storia di Martin Hartwell, pilota di un bimotore Beechcraft precipitato nei desolati e freddi territori del Canada. Hartwell pilotava l'aero per un volo di evacuazione medica verso un ospedale per ricoverare un giovane eschimese con una sospetta appendicite, assistito da una infermiera e accompagnato dalla zia, incinta.
Gli uomini che sorvolavano la zona durante le ricerche dell'aereo, lo hanno visto agitare un bengala vicino al relitto.
 |
| Hartwell durante una intervista dopo il suo salvataggio |
Hartwell pilotava un aereo medevac da Cambridge Bay a Yellowknife quando si è schiantato nei pressi di Hottah Lake, a circa 300 chilometri a nord di Yellowknife.
Due dei tre passeggeri morirono per le ferite riportate nello schianto.
Hartwell e l'altro sopravvissuto, il quattordicenne David Kootook, dovettero sopportare temperature prossime a -40 in attesa di essere salvati.
Hartwell aveva le caviglie fratturate e non era in grado di camminare; il ragazzo costruì un riparo, raccolse la legna per il fuoco, pescò il pesce del vicino lago e mise delle trappole; in una occasione si allontanò dal relitto dell'aereo per più di due giorni per cercare aiuti.
David Kootook morì di fame e sfinimento una settimana prima dell'arrivo dei soccorsi, il 1 Dicembre 1972.
Hartwell per sopravvivere dovette nutrirsi della carne dell'infermiera, ma dichiarò che il ragazzo si astenne da atti di cannibalismo prima di morire.
La famiglia del ragazzo ricevette nel 1994 una medaglia, per il riconoscimento del suo coraggio e bravura, da parte delle autorità canadesi.
------------------------------------------------------------------------------------------------------------------
------------------------------------------------------------------------------------------------------------------
 |
| Un Beech 18 simile all'aereo precipitato in Canada |